CHEMICKÉ LÁTKY
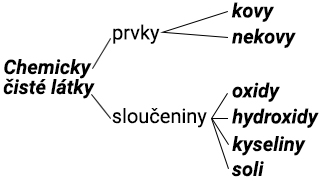
1. Prvky jsou látky tak jednoduché, že se už chemicky rozdělit nedají. Prvek je tvořen atomy stejných chemických vlastností. Je tolik druhů atomů, kolik je prvků. Dosud známe 92 prvků přirozených a 15 prvků umělých. V zemské kůře jsou prvky zastoupeny takto:
složení zemské kůry
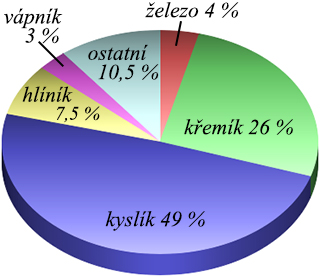
Kyslík 49 %, křemík 26 %, hliník 7,5 %, železo 4 %, vápník 3 %, sodík 2,5 %, draslík 2,5 %, hořčík 2,5 % a vodík 1 %. To je 98 % tvořených devíti prvky. Na ostatních 83 prvků zbývají pouze 2 %!
Relativní atomová hmotnost je číslo udávající, kolikrát je hmotnost atomu určitého prvku větší než jedna dvanáctina hmotnosti izotopu uhlíku 12C.
Prvky dělíme na kovy a nekovy. (Viz tabulka prvků.)
2. Sloučeniny jsou látky složené ze dvou nebo z více prvků. Prvky jsou v nich navzájem chemicky vázané (voda, sůl kuchyňská, soda apod.). Prvek označujeme chemickou značkou, sloučeninu chemickým vzorcem. Vzorec udává, z jakých prvků je tvořena sloučenina a v jakém poměru jsou v molekule sloučeniny jejich atomy. Relativní molekulová hmotnost sloučeniny je dána součtem relativních atomových hmotností všech jejích prvků. (Relativní atomová hmotnost uhlíku C je 12, kyslíku O je 16. Relativní molekulová hmotnost oxidu uhličitého CO2 je tedy 12 + (16 · 2) = 44.) Uhlík a kyslík jsou sloučeny v poměru hmotností 12 : 32. Ve 44 g CO2 je tedy 12 g uhlíku a 32 g kyslíku. Chemická značka značí atom, vzorec značí molekulu. Spojením atomů stejného prvku vzniká molekula prvku, spojením atomů různých prvků vzniká molekula sloučeniny.
Kapalné a tuhé prvky tvoří molekuly s mnoha atomy, plynné prvky tvoří molekuly obyčejně ze dvou atomů.
| rok 400 př. n. l. | 10 | měď, zlato (5000), železo (2000), rtuť (400) |
| 1600 | 1 | jen arsen (asi 1250) |
| 1650 | 0 | |
| 1700 | 1 | jen fosfor (1669) |
| 1750 | 3 | platina , zinek (1735), nikl (1751) |
| 1800 | 17 | chlor (1774), dusík (1777), uran (1789), ~ chrom (1/98) |
| 1850 | 27 | sodík (1807), vápník (Í808), křemík (1823},’ hliník (1825) |
| 1900 | 24 | fluor (1886), argon (1894), radium, neon (1898) |
| 1950 | 15 | neptunium, plutonium (1940), kalifornium (1950) |
| 1994 | 13 | einsteinium (1952), mendelevium (1955), kurčatovium (1964) |
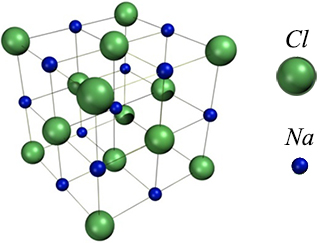
Struktura krystalu chloridu sodného NaCl (kuchyňské soli).
Samostatné atomy se v přírodě vyskytují jen ojediněle. Jejich spojení v molekule se nazývá chemická vazba. O vzácných plynech víme, že jsou mimořádně chemicky stabilní, netečné. Je to dáno tím, že mají svou valenční slupku úplně obsazenou osmi valenčními elektrony (elektronový oktet — s výjimkou helia, kterému k úplnému obsazení stačí dva, elektronový dublet). Ostatní prvky mají valenční slupku obsazenou 1 až 7 elektrony a mají snahu doplnit svou valenční slupku a dosáhnout stabilního stavu.
Iontová vazba je založena na tom, že prvky, jimž elektrony ve valenční slupce přebývají, je předají prvkům, kterým scházejí. Prvnímu atomu pak elektrony scházejí a má kladný náboj (kation), druhému naopak přebývají a má záporný náboj (anion). Navzájem se silně přitahují a uvolní se množství energie. V kapalném stavu (roztok, tavenina iontové sloučeniny) se mohou ionty pohybovat a elektrolyt vede elektrický proud. Kationty se pohybují k záporné elektrodě, anionty ke kladné (podstata elektrolýzy).
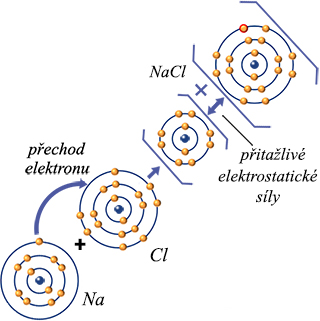
Iontová vazba chloridu sodného NaCl. kuchyňské soli.
U kovalentní vazby dochází ke společnému sdílení valenčních elektronů atomy, přičemž vzniká přitažlivá síla mezi sdílenými elektrony a jádry atomů. Podle toho, kolik elektronů atomy sdílejí, rozlišujeme jednoduchou (např. fluor, chlor), dvojnou (kyslík, voda), trojnou (dusík) a čtyřnásobnou (sloučeniny uhlíku).
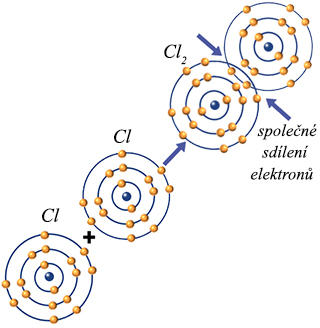
Kovalentní vazba dvouatomové molekuly chloru.
Kovová vazba, jak název napovídá, se uplatňuje u kovů. Atomy uvolňují elektrony z valenčních slupek, elektrony se ale nepřipojují k jiným atomům, ale vytvářejí tzv. elektronový oblak, v němž se volně velkou rychlostí pohybují a vytvářejí přitažlivé síly, které poutají ka-tionty v mřížce. Proto kovy dobře vedou elektrický proud.
3. Směsi jsou látky, jejichž různorodé složky můžeme okem nebo mikroskopem rozeznat nebo fyzikálně od sebe oddělit. (Třeba ze směsi písku a železných pilin oddělit magnetem železo od písku.)
Jemné částečky pevných látek rozptýlené v kapalině tvoří suspenzi (hlína ve vodě). Drobné kapičky kapaliny rozptýlené v jiné kapalině tvoří emulzi. Pevné látky oddělujeme od kapalin filtrací. Kapalina proteče filtrem jako filtrát. Směsi stejnorodé tvoří roztoky (sůl ve vodě). Roztok může být tuhý (slitiny, sklo), kapalný i plynný. Roztok je směs molekul látky rozpuštěné v rozpouštědle. Známe roztoky nasycené (za studená i za varu), zředěné a koncentrované. Látky jsou rozpustné a nerozpustné. Rozpustnost látky udává její největší množství, které se rozpustí ve 100 gramech rozpouštědla při určité teplotě. (Rozpustnost většinou stoupá se stoupající teplotou.)
Koncentrace roztoku je množství rozpuštěné látky (v g) v určitém množství roztoku. (5% roztok cukru znamená, že ve 100 g roztoku je 5 g cukru.)
Složky směsí od sebe oddělujeme plavením a usazováním (sedimentací), odstřeďováním a filtrací, odpařováním a krystalizací, destilací a sublimací a flotací (např. při úpravě rudy).
Destilace je oddělování kapaliny z roztoků varem; vzniklé páry se chlazením srážejí, zkapalňují. Vzniká destilát.
Sublimací přechází skupenství tuhé přímo v plynné (jod, naftalen, suchý led, tj. pevný oxid uhličitý).
ROZDĚLENÍ CHEMICKÝCH LÁTEK